神経科学領域ではウイルスを用いて機能タンパク質を細胞に導入する手法が広く用いられています。
近年では安全性の高さや発現の安定性、多様な*ベクターを比較的容易に入手できることからAAV(Adeno-Associated Virus:アデノ随伴ウイルス)が良く用いられています。今回はAAVの中でも、特にAAV1(セロタイプ1)を用いたTranssynaptic(シナプスを超える) labelingについて解説します。実験計画を立てる際の注意点などについても触れますので、少しでも参考になれば幸いです。
*ベクター:外来遺伝物質を人為的に運ぶために利用されるDNA/RNA分子。ラテン語の運び屋 (vehere) に由来。プラスミドベクター、ウイルスベクター、人工染色体ベクターなどの種類があるが、要は人為的に遺伝子を移動させるのに使用される核酸の総称。
今回主に参考にした文献は以下の3報で、いずれも同一著者によるものです。
①2017年, Neuron, Brian Zingg, Li I. Zhangら著、” AAV-mediated anterograde transsynaptic tagging: mapping corticocollicular input-defined neural pathways for defense behaviors”1
②2020年, The Journal of Neuroscience, Brian Zingg, Li I. Zhangら著、“Synaptic Specificity and Application of Anterograde Trans-Synaptic AAV for Probing Neural Circuitry”2
③2022年, Current Protocols, Brian Zingg, Li I. Zhangら著、”Application of AAV1 for Anterograde Transsynaptic Circuit Mapping and Input-Dependent Neuronal Cataloging”3
① AAVを用いた機能タンパク質の導入
AAVは一本鎖DNAウイルスであり、約4.7kb長のゲノムを持っています。基本的に細胞表面の受容体を介した*エンドサイトーシスにより細胞内へ侵入し、その後核内に輸送されます。
AAVに関する基本知識はまた別記事で扱えればと思いますが、ウイルスゲノム中の遺伝子を目的の遺伝子に置換し、標的細胞に感染させることで、目的の遺伝子から転写・翻訳されるタンパク質を発現させることが可能です。
ウイルスを感染させる標的細胞のことを「宿主細胞」、標的細胞に発現させる遺伝子のことを「導入遺伝子」と呼びます。
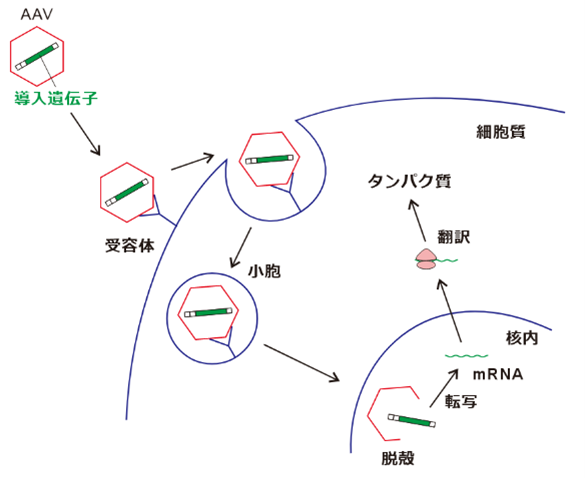
*エンドサイトーシス:細胞外の物質を細胞膜によって内側に陥凹しながら包み込み、小胞として細胞内に取り込む過程。細胞膜を通り抜けられない物質を細胞内に取り込む経路として重要。
② AAVの血清型(セロタイプ)
現在までに自然界から分離されたAAVの血清型(セロタイプ)は12-13種類ほど知られています。自然界由来以外の変異株や人工的に設計されたカプシド(殻)などは100種類以上が報告されています。
これほど多くの種類が開発されている理由は、AAVのカプシドが細胞表面受容体と結合してエンドサイトーシスを引き起こすため、カプシド構造の違いによって指向性(tropism:どの組織・細胞種に感染しやすいか)や感染効率が変化するからです。例えば、AAV7は骨格筋、AAV8は肝臓への指向性が高いことで知られています。中枢神経系については比較的多くのセロタイプが効率よく感染しますが、例えばAAV5はアストロサイトに効率よく感染する、AAV9は条件によって血液脳関門を通過するなど、やはりセロタイプによって感染の振る舞いには違いがあります。
近年はAAVを用いた遺伝子導入をヒトの遺伝疾患治療につなげる研究も盛んであるため、2026年現在でも、より高効率な、狙った臓器により指向性のある新規AAVの開発は盛んに行われています。
③ 神経科学におけるAAVを用いた感染実験
AAVを用いた遺伝子導入の方法は非常にシンプルで、AAV粒子を含む溶液を目的の経路から投与するだけです。
投与経路はいくつかありますが、大きく分けると中枢神経の局所に感染させるか全体に感染させるかです。
中枢神経の局所に感染させる方法は、標的の脳領域に直接針を物理的に刺して、その部分に少量溶液を注入します。
一方で全体に感染させる方法としては経静脈投与、脳室内投与、髄膜腔投与などがあります。
経静脈投与は最も簡便ですが、AAVは原則として血液脳関門を通過しにくいため、血液脳関門が未成熟な時期に投与するか、AAV9などの血液脳関門を通過可能なセロタイプを使用する必要があります。またマウスの中枢神経系に静脈投与で高効率に遺伝子導入可能なAAV-PHP.eB4なども開発されています。
上記の投与経路は投与対象が動物の場合ですが、培養皿上の細胞などに感染させたければ、AAV粒子が含まれる溶液を振りかけるだけで大丈夫です。
④ 神経科学領域でよく用いられるプロモーター、機能タンパク質
AAVに導入遺伝子をパッケージングする際に、一緒にプロモーター配列も組込む必要があります。プロモーターとは遺伝子の上流に位置し、遺伝子の発現を開始させる役割をもつDNA配列のことです。
AAVを投与すると、基本的には神経細胞だけでなく他のグリア細胞などにも感染は生じますが、プロモーターの中には細胞種特異的に働くプロモーターもあり、導入タンパク質を発現させたい細胞種をコントロールすることも可能です。
神経科学領域でよく用いられるプロモーターの例は以下の通りです。
汎用プロモーター(細胞種に関わらず高発現):CAG、EF1α
特異的プロモーター:hSyn(Synapsin; ニューロン)、CamKIIa(興奮性ニューロン)、GFAP(アストロサイト)、MBP(オリゴデンドロサイト)
また導入遺伝子も様々なものが用いられますが、代表例はEGFPやtdTomatoといった蛍光色素、チャネルロドプシン(ChR)やDREADDといった神経活動を操作する人工タンパク質、CreやFlpのようなリコンビナーゼあるいはsiRNAのような特定の遺伝子発現を制御するものなどです。
*リコンビナーゼ:DNAの組換え反応を触媒する酵素の総称。特定のDNA配列を認識して、切断・再結合を触媒する
⑤ AAV1を用いたTranssynaptic labeling
ここからようやく本題に入りますが、今回は上記で説明した投与経路のうち、特に局所導入の場合に注目します。恐らく、この投与方法が動物を使用する神経科学の研究では一番用いられているのではないかと思います。というのも、中枢神経は多数の脳領域に分かれており、それぞれが異なる機能や解剖構造をもっているため、特定の脳領域のみを狙ってAAVを感染させたいことが多いからです。
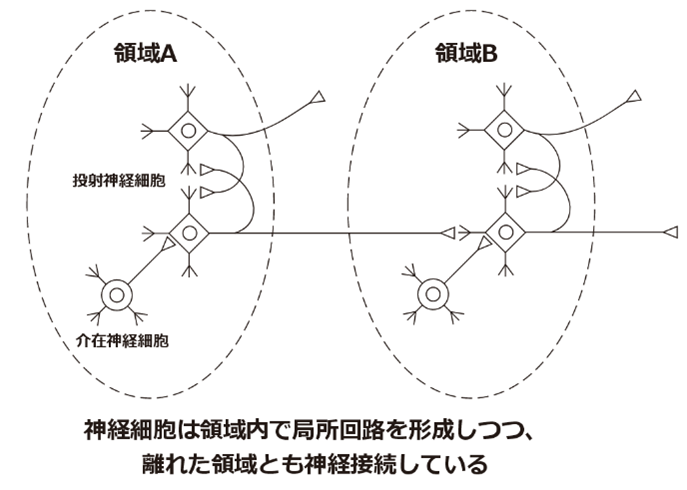
神経細胞は軸索や樹状突起でシナプスを形成して、細胞同士が機能的に接続しています。ある脳領域の神経細胞は、その脳領域内の神経細胞同士で接続するだけではなく、長い軸索を伸ばして領域外の神経細胞とも接続しています。これにより膨大な数の神経細胞がネットワーク回路を形成して複雑な情報処理が可能となります。(図は簡略化のため、神経細胞だけを描いています)
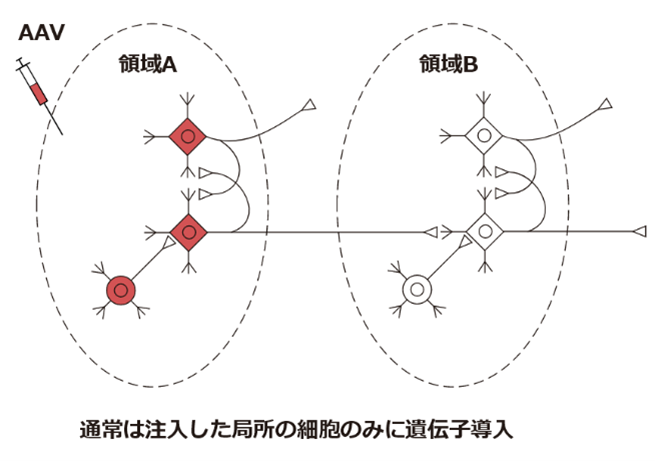
通常、AAVを局所投与して感染させた場合、その局所に存在している細胞のみに遺伝子導入がされます。(図では遺伝子が導入された細胞を赤色で示しています)
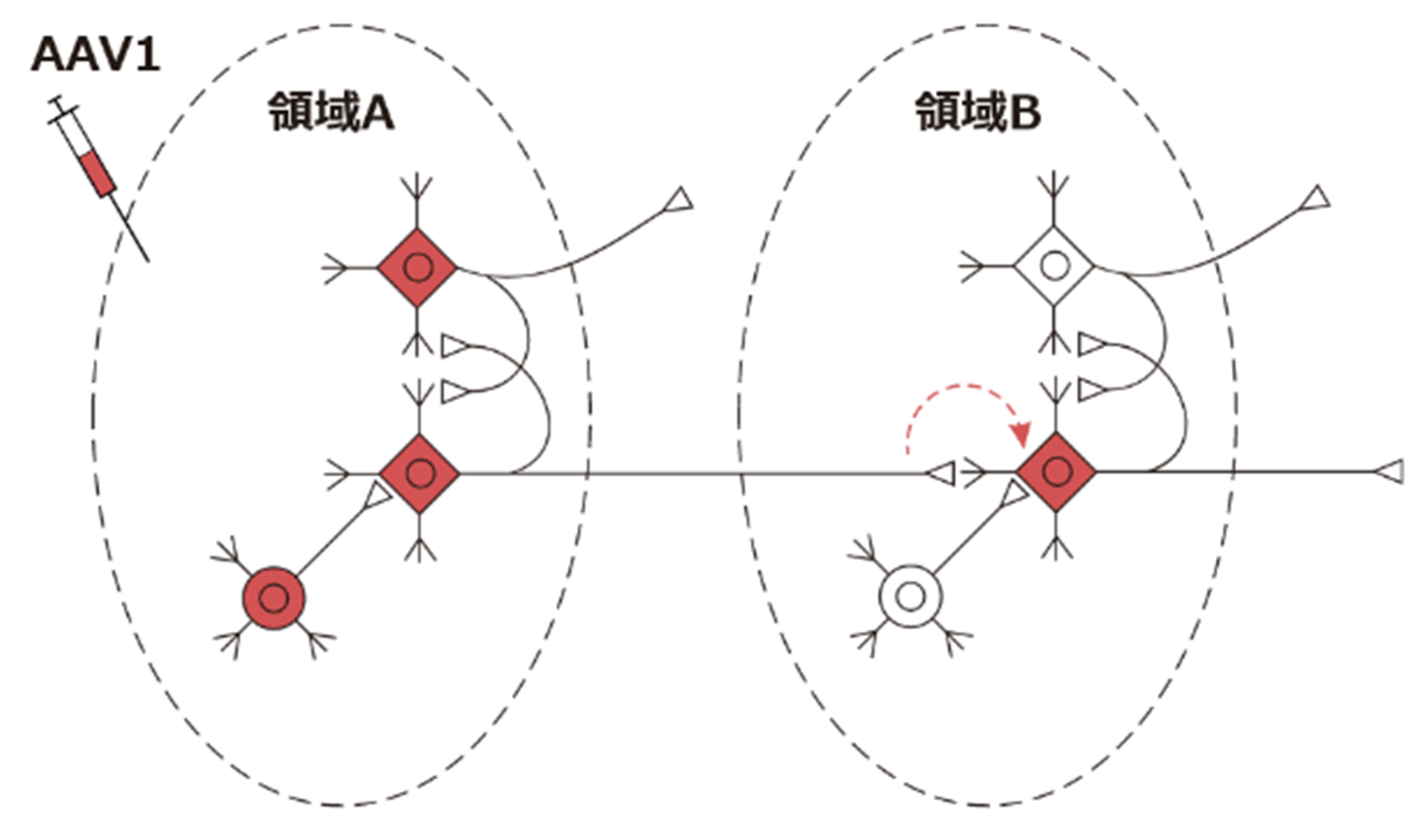
しかし今回取り上げるAAV1はシナプスで接続している下流の神経細胞にも遺伝子導入することができます。(ただし主に報告されている動物はマウスとラットです。霊長類などでのエビデンスは現時点では限られています)
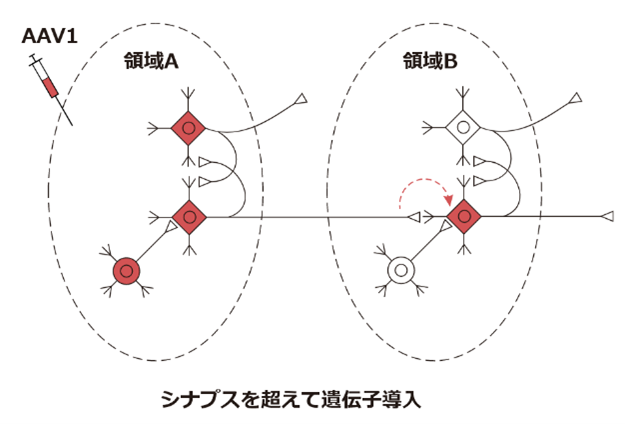
またマウスにおいて、軸索終末から取り込まれて、逆行性に上流の神経細胞に遺伝子導入ができるAAV2-retro5なども開発されています。
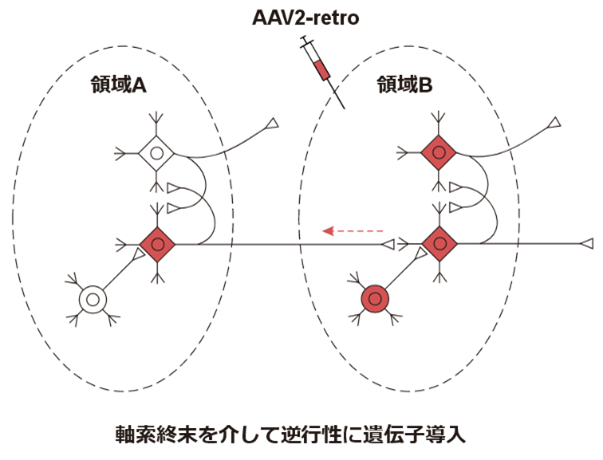
さてここで大事な注意点があります。AAV1はシナプスを超えて遺伝子導入が可能と書きましたが、それは注入領域と同程度ではありません。あくまで注入領域で細胞内に取り込まれたAAV1のごく一部がシナプスを介して次の神経細胞に作用するだけなので、その量は注入領域と比べるとわずかです。
今回の文献のBrain Zinggらは*AAV1-hSyn-CreとAAV1-hSyn-GFPを*Ai14マウスに投与しています。Ai14マウスは遺伝子改変マウスでCreの存在下でtdTomatoという赤色蛍光色素を発現するように作製されています。
このとき、注入領域の下流では、tdTomatoでラベルされた神経細胞は存在しましたが、緑色のGFPでラベルされた神経細胞は存在しませんでした。これはGFPが発現していたとしても、顕微鏡で検出できる感度以下のごく少量しか発現していない一方で、Creリコンビナーゼはごく少量でも機能的に働く、ということです。このようにシナプスを超えた導入遺伝子の発現量は注入領域と比較するとごく少量のため、現在のところCreやFlpといった、ごく少量でも機能するリコンビナーゼが導入遺伝子として使用されています。
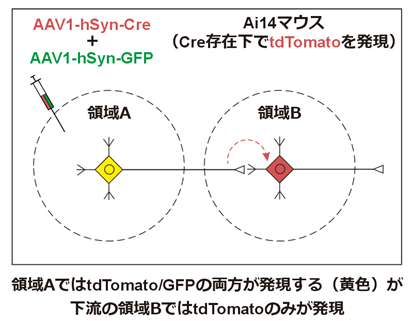
*AAV1-hSyn-Cre/AAV1-hSyn-GFP
AAVの表記は通例、「セロタイプ ー プロモーター ー 導入遺伝子」といった順番で記載されます。AAV1-hSyn-Creであれば、「AAVセロタイプ1でプロモーターは神経細胞特異的なhSynを使用しており、導入遺伝子はCreリコンビナーゼ」といった意味になります。
*Ai14マウス6
マウスには第6染色体上にRosa26という非コード遺伝子領域があります。この領域に外来遺伝子を挿入しても、他の遺伝子発現に影響を与えにくく、また導入した遺伝子の発現も安定しやすいことが知られており、「セーフハーバー(安全な港)」と呼ばれています。
Ai14マウスはこのRosa26座位にCAGプロモーター、その下流にloxP配列(Creの認識領域)で挟まれた転写停止カセット(STOP cassette)、さらにその下流にtdTomato遺伝子が挿入されています。
通常はこのSTOPカセットによって tdTomato は発現しませんが、Creリコンビナーゼの存在下ではSTOPカセットが除去され、tdTomatoが転写・発現されるようになります
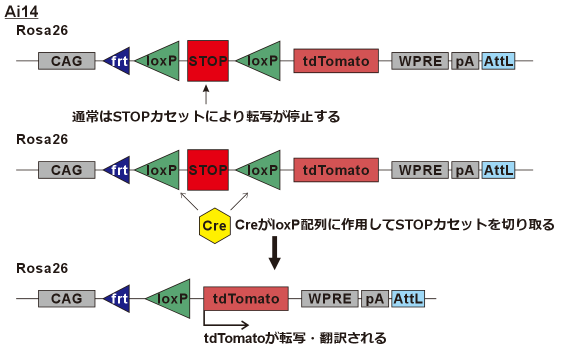
https://www.jax.org/strain/007914 を参考に作成
⑥ AAV1によるTranssynaptic labelingの用途・メリット
Transsynaptic labelingには様々な用途があります。
例えば単純なトレーサーを用いた実験で領域Aの神経細胞が領域Bに軸索を伸ばしているのはわかっても、「領域Aの軸索は本当に領域Bの神経細胞とシナプス接続しているのか。単に通過しているだけではないのか。」「領域Bのどの神経細胞が領域Aから入力を受けているのか」といった点を明らかにするには、追加で電気生理学的な実験などが必要でした。
前述のようにAi14といったレポーターマウスにAAV1-hSyn-Creを局所注入することで、上記のような問いに対して、有力な手掛かりを与えることができます。
その他、Cre依存的にtdTomatoを発現するAi14マウスとFlp依存的にEGFPを発現する*RCE:FRTマウス7,8を掛け合わせた、Ai14 x RCE:FRTマウスにCre/Flp両リコンビナーゼを利用することで、異なる2領域から入力を受けている神経細胞を標識したりもできます。
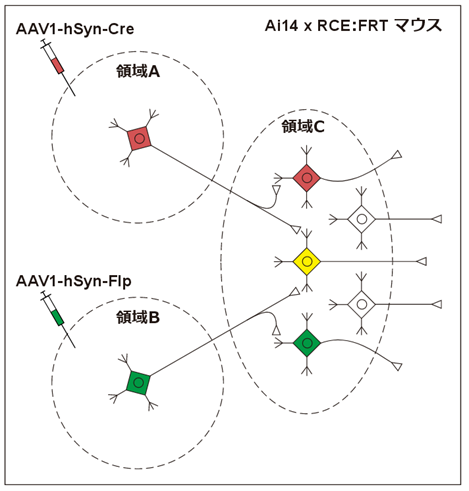
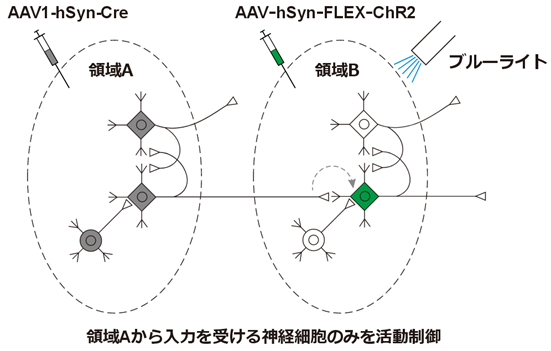
またChR2(チャネルロドプシン)のような神経活動を人工的に制御できるようなタンパク質を組み合わせると、「領域Bの神経細胞のうち、領域Aから入力を受けるものだけを制御する」といったことも可能になります。
(下図のFLEXはCre存在下でのみ導入遺伝子を発現させるシステムです)
AAV1以外にもウイルスを用いたTranssynaptic labelingはこれまでも開発されてきました。例えばHSV1 H129(単純ヘルペスウイルス1 H129株)やVSV(水疱性口内炎ウイルス)などです。
AAVを用いる一番の利点は安全性が高いことです。毒性が低く、人体への影響も少ないことが確認されており、原則としてBSL1(バイオセーフティーレベル1)施設での使用が可能です。一方でH129やVSVはBSL2以上が求められ、適切な設備を準備しなければ取扱いできません。
安全性や実験導入の容易さは、数多くの研究グループで利用されることにつながり、さらに使用人口が増加することで、その開発が促進されます。現在は購入利用可能なAAVベクターやAAV作製サービスなども豊富です。
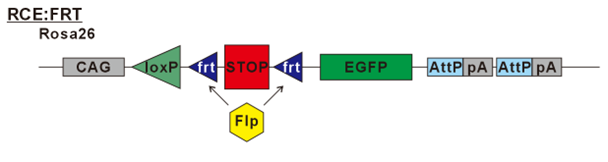
* RCE:FRTマウス
Ai14マウスと同じく、Rosa26座位に、CAGプロモーター、frt配列で挟まれたSTOPカセット、その下流にEGFPを挿入した遺伝子改変マウス。Flpリコンビナーゼがfrt配列を認識して、STOPカセットを切り取ることで、緑色蛍光物質であるEGFPが発現する。
*BSL(バイオセーフティーレベル):病原体の危険度に応じて、取り扱う実験施設や設備の安全性を分類した国際的基準。BSL1-4に分類され、数字が大きいほど危険性が高く、より厳重な封じ込め設備と管理体制が必要になる。
⑦ AAV1を用いたTranssynaptic labelingの注意点
ここまでAAV1を用いたTranssynaptic labelingの仕組みについて概説してきました。Brian Zingg, Li I. Zhangらのグループは、参考論文の中で、実験プロトコール計画の際の注意点を挙げてくれていますが、この節ではそれをまとめようと思います。
A) AAVベクターの設計
・プロモーター
CAGやEF1αのような細胞種に関わらず強い遺伝子発現を誘導するプロモーターも存在しますが、この場合は神経細胞だけでなくグリア細胞などでも導入遺伝子が発現します。アストロサイトという種類のグリア細胞は神経活動調整のためシナプスに密接にコンタクトしており、そのためシナプスを超えてアストロサイトでも導入遺伝子が発現する可能性があります。それを避けるため、シナプス特異的なhSynプロモーターが推奨されています。
・リコンビナーゼ
リコンビナーゼはここまで紹介してきたCre/loxやFlp/frtシステム以外にも、Dre/rox、Nigri/noxシステムなど多くの選択肢が開発されてきています。一番多く使われているのはCre/loxシステムだと思われますが、本文中にはリコンビナーゼの選択についても言及されています。
まずはリコンビナーゼの作用効率です。システムによって少々作用効率が変わるようで、FlpOはCreよりも少々効率が落ちるようです。またいくつかのリコンビナーゼタンパクは哺乳類での実験に適するように、オリジナルの配列から修正されており、”codon-optimized”の意味でoを付けて表記されたり(FlpO, DreO, oNigriなど)、”improved”の意味でiを付けて表記されたり(iCreなど)します。
そして複数のリコンビナーゼシステムを組み合わせる際は交差性も重要です。これまでにCre/loxシステムとDreO/roxシステムの交差反応性が報告されているようです(つまりCreがrox配列を、DreOがlox配列を認識して組換え反応を触媒するということです)。一方でCre/loxシステムとFlpO/frtシステムはそれぞれ交差性なく働くことが分かっており、安全な組み合わせとされています。
・WPREエンハンサーの使用
エンハンサーとは遺伝子の発現量を増加・安定させるDNA配列のことです。WPREはウッドチャック肝炎ウイルス転写後調節エレメント(Woodchuck hepatitis virus Posttranscriptional Regulatory Element)の略称で、AAVベクターではよく用いられる配列です。CreやFlpOにおいてもWPRE配列がTranssynapticな遺伝子発現を促進することがわかっています。しかし一方で、これが細胞毒性と関連する可能性も指摘されています。
実際にBrian Zingg, Li I. ZhangらのグループはWPRE配列を含んだ、AAV1-hSyn-Cre-WPREを使用し、注入部位での細胞死を確認しています。細胞死を引き起こすメカニズムについて、断定はできませんが、WPREエンハンサーにより過剰に発現したリコンビナーゼがoff-target効果により本来の標的部位とは異なるDNA領域とも反応を起こしてしまい、それが細胞のDNAにダメージを与えることが一因ではないかと推測されています。
このため著者らは、単純な解剖をみるだけでなく、神経の機能的な面をみる実験の場合は、WPRE配列を含むAAVは避けることを推奨しています。この機能をみる実験とは、ある細胞集団が神経活動全体にどのような影響を与えるのか、動物個体の行動にどのような影響を与えるのかを調べる実験ということです。具体的には目的の細胞集団にChR2を発現させて、神経活動操作が動物の行動をどう変化させるのかをみる実験などのことを指します。
B) 力価(Titer)や投与量について
AAVの力価(Titer)とは、ウイルスの感染しやすさを反映した値で、いくつか測り方が存在します。実際に導入遺伝子の発現効率を計測する方法もありますが、神経科学領域で一番用いられるのは単純に単位容積あたりのウイルスゲノム数をqPCRなどで測定する方法です。単位は、GC/mL [genome copy/mL]やvg/mL [vector genome/mL]などで表現されます。
Transsynaptic labelingの際は、AAVがシナプスを超えた下流の神経細胞で十分有効な導入タンパク量を発現させるのに、一定以上の力価のAAV1を投与する必要があります。著者らによると、5.0×1011 GC/mL程度を下回ると、検出感度以下の拡散能力になるとのことで、1.0×1013 GC/mL以上が推奨されています。
ウイルス溶液の投与量としてはマウスであれば1か所50-150 nL程度がよく用いられます。この投与量を大幅に超えると物理的な注入圧による組織障害や標的領域を大きく超えて溶液が拡散したりしてしまいます。逆に投与量が少なすぎると、必要なウイルス粒子数が投与できず、導入タンパクの発現が不十分になります。
投与量を減らす方法として、さらに高い力価:~1.0×1014 GC/mL程度のウイルスを準備したり、*scAAV1のような、より効率的な種類のAAVを利用する方法があります。
*scAAV: Self-complementary AAV(自己相補型AAV)
通常のAAVベクターは一本鎖DNAで構成されているが、scAAVは二本鎖DNAをベクターとして内包している。これにより、宿主細胞の核内で脱殻した後、二本鎖を構成する段階をスキップできるため、高効率な遺伝子発現が達成できる。(詳細はまた別記事で扱えればと思います。)
C) 実験対象とする神経回路について
AAV1によるTranssynaptic labelingを適用する神経回路についても少し注意点があります。
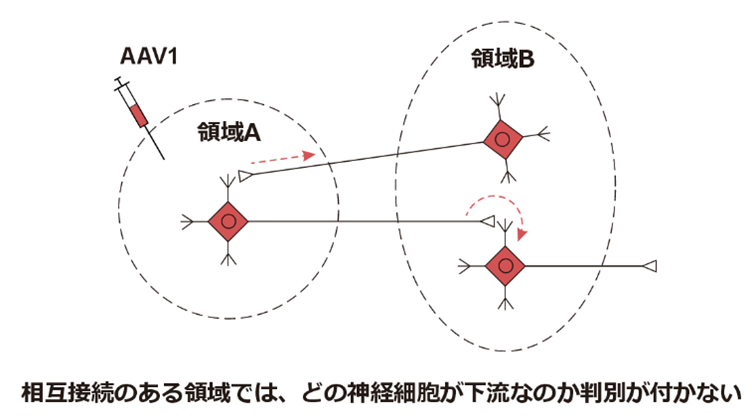
一つ目は、AAV1には弱いものの逆行性輸送能があるという点です。逆行性輸送能とは、項目5でも触れたように、軸索終末から取り込まれて、上流の神経細胞の核まで運ばれて導入遺伝子を発現させる能力のことです。
このAAV1の逆行性輸送能により相互に神経接続を形成しているような脳領域間ではAAV1の使用を避けるのが無難です。というのも下図に示しているように、例えば領域AにAAV1を注入して、領域Bの神経細胞がラベルされたとします。しかしながら領域Aと領域Bが相互に投射していれば、ラベルされた神経細胞が「領域Aから投射を受けている神経細胞」なのか「領域Aに投射している神経細胞」なのか区別することが困難です。そのためAAV1を用いたTranssynaptic labelingは、領域A→領域Bのように一方向性とわかっている神経回路に使用するのが適切です。
一方向性かどうか調べるには、例えばAllen Mouse Brain Connectivity Atlas(https://connectivity.brain-map.org/)のようなデータベースを用いたり、実際に神経トレーサーを用いて双方向性の投射がないかを予め確認しておく方法などがあります。
2つ目は細胞の種類によってシナプスを超える効率は変わるという点です。具体的に言えば、一般的な興奮性神経細胞(グルタミン作動性)、抑制性神経細胞(GABA作動性)ではほぼ同じ効率でTranssynaptic labelingが達成されますが、神経調節性(neuromodulatory)神経細胞であるドーパミン作動性神経細胞やセロトニン作動性神経細胞では、Transsynaptic labelingの効率が低いといわれています。
⑧ まとめ
ここまでAAV1を用いたTranssynaptic labelingについて説明してきました。
AAV1の導入遺伝子としてCreなどの少量でも効果を十分に発揮するリコンビナーゼである必要があります。またある程度高力価(~1.0×1013 GC/mL)なウイルスを準備する必要があることや、適用できる神経回路が限定的(一方向性で、グルタミン作動性もしくはGABA作動性神経細胞)など注意点も多いですが、安全性や実験準備の容易さ、ベクターの豊富さなど場面を選べば利点の多いとても強力なツールだと思います。
引用
- Zingg B, Chou XL, Zhang ZG, Mesik L, Liang F, Tao HW, Zhang LI. AAV-Mediated Anterograde Transsynaptic Tagging: Mapping Corticocollicular Input-Defined Neural Pathways for Defense Behaviors. Neuron. 2017 Jan 4;93(1):33-47. doi: 10.1016/j.neuron.2016.11.045.
- Zingg B, Peng B, Huang J, Tao HW, Zhang LI. Synaptic Specificity and Application of Anterograde Transsynaptic AAV for Probing Neural Circuitry. The Journal of Neuroscience. 2020 Apr 15;40(16):3250-3267. doi: 10.1523/JNEUROSCI.2158-19.2020.
- Zingg B, Dong HW, Tao HW, Zhang LI. Application of AAV1 for Anterograde Transsynaptic Circuit Mapping and Input-Dependent Neuronal Cataloging. Current Protocols. 2022 Jan;2(1):e339. doi: 10.1002/cpz1.339.
- Chan KY, Jang MJ, Yoo BB, Greenbaum A, Ravi N, Wu WL, Sánchez-Guardado L, Lois C, Mazmanian SK, Deverman BE, Gradinaru V. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 2017 Aug;20(8):1172-1179. doi: 10.1038/nn.4593.
- Tervo DG, Hwang BY, Viswanathan S, Gaj T, Lavzin M, Ritola KD, Lindo S, Michael S, Kuleshova E, Ojala D, Huang CC, Gerfen CR, Schiller J, Dudman JT, Hantman AW, Looger LL, Schaffer DV, Karpova AY. A Designer AAV Variant Permits Efficient Retrograde Access to Projection Neurons. Neuron. 2016 Oct 19;92(2):372-382. doi: 10.1016/j.neuron.2016.09.021.
- Madisen L, Zwingman TA, Sunkin SM, Oh SW, Zariwala HA, Gu H, Ng LL, Palmiter RD, Hawrylycz MJ, Jones AR, Lein ES, Zeng H. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nature Neuroscience. 2010 Jan;13(1):133-40. doi: 10.1038/nn.2467.
- Sousa VH, Miyoshi G, Hjerling-Leffler J, Karayannis T, Fishell G. Characterization of Nkx6-2-derived neocortical interneuron lineages. Cerebral Cortex. 2009 Jul;19 Suppl 1(Suppl 1):i1-10. doi: 10.1093/cercor/bhp038.
- Taniguchi H, He M, Wu P, Kim S, Paik R, Sugino K, Kvitsiani D, Fu Y, Lu J, Lin Y, Miyoshi G, Shima Y, Fishell G, Nelson SB, Huang ZJ. A resource of Cre driver lines for genetic targeting of GABAergic neurons in cerebral cortex. Neuron. 2011 Sep 22;71(6):995-1013. doi: 10.1016/j.neuron.2011.07.026.